Un accompagnement et une prise en charge totale
Affaires réglementaires
Documentation technique
SMQ
Audit
Certification ISO 13 485 et marquage CE
Assurance qualité et affaires réglementaires
Centaur clinical CRO dispose d’un panel d’experts pour l’accompagnement et/ou la prise en charge du dossier technique du dispositif selon la réglementation européenne (RDM 2017 / 745 – 746) et du système de management de la qualité (SMQ) de l’entreprise selon l’ISO 13 485.
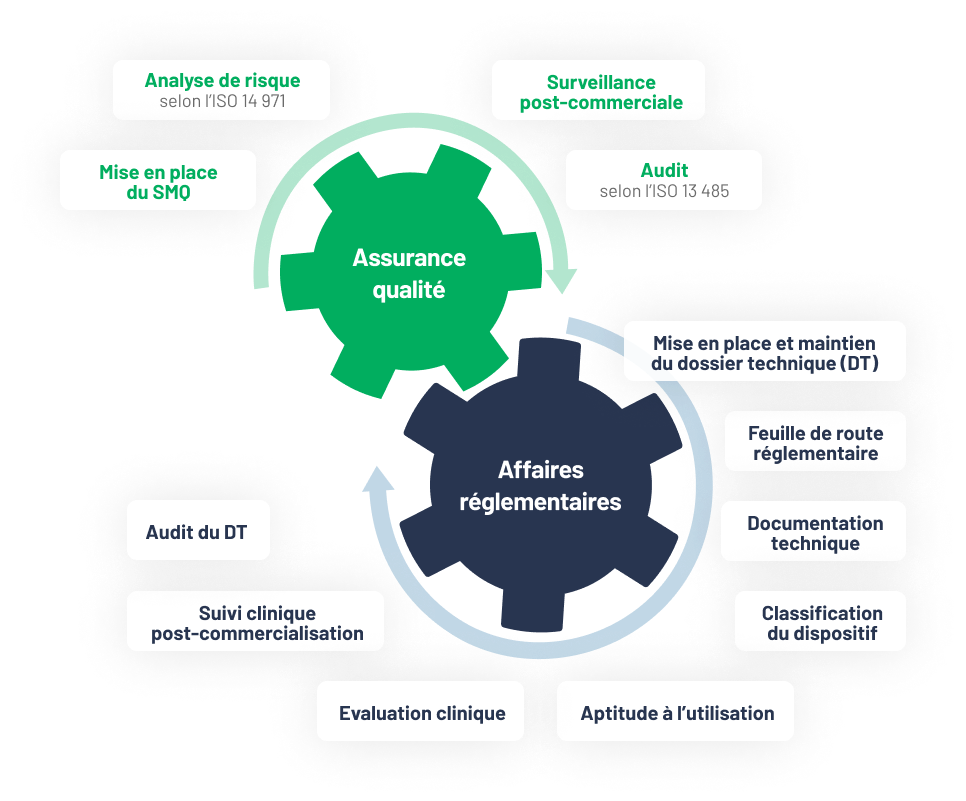
Centaur Clinical intervient à n’importe quel stade du DT et du SMQ.
Nous accompagnons le fabricant pendant le processus de certification CE avec l’organisme notifié.
Pour tout savoir sur les Affaires Règlementaires, téléchargez notre livre blanc en .pdf
Faites appel à notre équipe d’experts pour un accompagnement dédié et optimisé
Parce que le temps est votre allié, bénéficiez de notre expertise et de notre expérience pour amener votre dispositif médical sur le marché ou conduire vos essais cliniques sur les médicaments.
TÉMOIGNAGES
Nos clients satisfaits parlent de nous
Nous démarrons une investigation clinique avec Centaur Clinical et nous sommes pour l’heure très satisfaits de notre collaboration. La préparation de la soumission aux autorités est une période stressante et chronophage qui mobilise du personnel qualifié. Les équipes de Centaur Clinical ne manquent pas de nous apporter leur expertise, disponibilité et support.

Centaur Clinical nous a aidé à définir un rationnel et une stratégie d'investigation clinique solide et cohérent vis-à-vis des attentes des ON relativement à l'application du RDM et des preuves cliniques nécessaires à apporter.
